日本では1年間に数十種類の新薬が誕生しています。
医薬品や医療機器は、その基礎研究から製造販売承認取得まで10年以上の歳月をかけるものも多く、その費用も数百億円と言われています。医薬品や医療機器はヒトの生命に密接に係わるものであり、特に臨床試験については「臨床試験の実施に関する基準(GCP;厚生労働省令)」に基づいて安全性や有効性の評価を日々行っています。
お薬ができるまで
医薬品開発の工程において、ヒトで安全性や有効性を調べることを臨床試験と呼び、特に医薬品や医療機器の製造販売の承認取得を目的とした臨床試験を 治験と呼んでいます。
(非臨床試験:動物を用いた安全性や有効性を調べる試験)
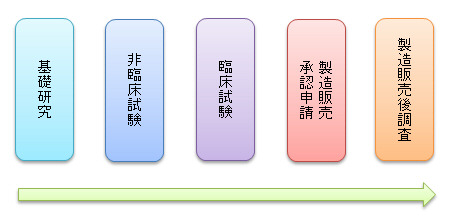
一般的に治験は段階的に進められていきます。
医薬品や医療機器の製造販売承認を取得するには第Ⅰ相試験から第Ⅲ相試験までを実施しなくてはなりません。
ここでは各試験についてご説明致します。
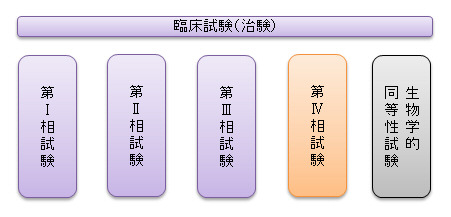
第Ⅰ相試験
第Ⅰ相試験では、原則として「健康な成人男性のボランティア」に治験薬を投与し、安全性と薬物動態について調べます。
薬物動態とは、薬が体内に入ってからの体内循環、特定の臓器への移行性、体内での薬物の変化、体外への排泄までの過程を指します。
この試験では、ヒトに安全に使える薬の量、可能性のある副作用のタイプと強さ、動物で得られたデータのヒトへの当てはめ方などの情報が得られます。
第Ⅱ相試験
第Ⅱ相試験では、少数の患者さんを対象に行います。
治験薬が目的とする病気の治療に効果があるのか、副作用は発生しているのか、用法・用量はどのくらいに設定するかなどを調べます。
第Ⅲ相試験
第Ⅲ相試験では、多数の患者さんを対象に行います。
同じ効果を持つ薬、または効果を持っていない薬(偽薬・プラセボ)と比較を行い、治療に効果があるのか、副作用は発生しているのか、市販済みの同じ効果を持つ薬に比べてどれだけのメリットがあるのかなど、実際の治療を想定した形での安全性と有効性について調べます。
第Ⅳ相試験 (製造販売後臨床試験)
第Ⅳ相試験では、厚生労働省によって承認された医薬品が市販され、全国の医療機関に出回るようになった段階で、一般の患者さんを対象に行われる試験です。
治験では現れなかった副作用なども十分予想されるため実施されます。
生物学的同等性試験
生物学的同等性試験は原則として「健康な成人男性のボランティア」に治験薬を投与し、既に市販されている薬と血液中の有効成分の薬物動態について調べる試験です。
第Ⅰ相~第Ⅳ相試験が新薬開発の際に行われる試験であるのに対し、生物学的同等性試験は主としてジェネリック医薬品開発の際に行われる試験です。
※ジェネリック医薬品
新薬(先発医薬品)と同一の有効成分で構成された医薬品であり、開発コストが低く、薬価も低く抑えられることから医療費抑制の一翼を担うものと期待されている医薬品です。

